|
Nakamura lab 東京理科大学 ● 生命医科学研究所 ● 生命情報科学研究部門 |

|

|

|
|
|||||||||||||
| トップページ 研究内容 研究室紹介 メンバー 発表論文 セミナー 講義資料 写真 アクセス リンク | |||||||||||||
研究内容 | |||||||||||||
分解経路の指揮者を操るもの
細胞内の分解経路には大きく分けて2つのシステムが存在します。そのうちエンドリソソームシステムは、細胞の中でのタンパク質と脂質の輸送と選別をコントロールしています。このエンドリソソームシステムでは、Rabタンパク質のうちのRab5とRab7が指揮者として働いています。Rab7は後期エンドソームとリソソームに存在しておりその分子機能については多くのことがわかっていますが、Rab7自体の活性(ON/OFF)制御についてはごく一部しかわかっていませんでした。ごく最近、Mon1とCcz1とが会合した複合体がRab7の活性化因子として働くことが報告されましたが、細胞の中で、Mon1-Ccz1複合体がRab7をいつどこで活性化しているかについては不明のままです。
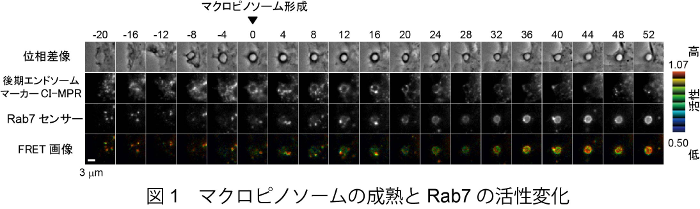
私たちは、2008年に開発したRab5の活性可視化センサー*1に続いて、Rab7のFRETセンサーを作製し、この問題に挑みました。まず定常状態にある細胞を観察すると、それぞれの後期エンドソームやリソソームの間でRab7活性にかなりのばらつきがあることがわかりました。この状態で酵素活性を担うCcz1をノックダウンすると、私たちも予期していなかったのですが、後期エンドソームのRab7活性だけが低下してリソソームのRab7活性には変化が見られませんでした。このことは、Mon1-Ccz1複合体は後期エンドソームでのみRab7の活性化を行っていることを意味します。
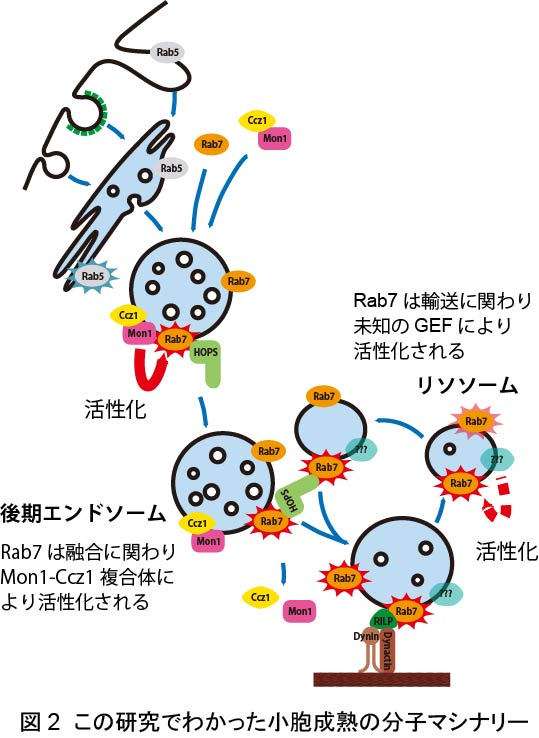
次に私たちは、直径が500 um以上と比較的大きいマクロピノソームを対象として、このマクロピノソームが後期エンドソームからリソソームへと移行する際にRab7活性がどのように変化するかを調べました(図1)。細胞の周辺部でマクロピノソームができ始めるとRab7は不活性型(GDP型)でマクロピノソームにやってきます。後期エンドソームに成熟するタイミングでマクロピノソーム上のRab7はMon1-Ccz1により活性型(GTP型)になります。その後、マクロピノソームはリソソームと融合してリソソームの性質を獲得しますが、その前にMon1もCcz1もマクロピノソームから離脱します。リソソームの性質を獲得したマクロピノソームでのRab7活性はそれ以前よりむしろ上昇しているので、「Mon1-Ccz1複合体以外にRab7活性化因子が存在し、それがリソソームでのRab7の活性化を行っている」という新たな見方が生まれたことになります(図2)。 生きている限り細胞にはゴミ(凝集体)がたまります。神経細胞に溜まったゴミはアルツハイマー病などの神経変性疾患につながります。エンドリソソームシステムはこうしたゴミを分解処理する仕組みなので、神経変性疾患が発症へと向かう最初期にエンドリソソームシステムの不調が起きていると考えられるようになっています。Rab5とRab7はエンドリソソームシステムというオーケストラの指揮者ですから、この不調のかなりの部分はRab5とRab7の活性や量の制御とつながっている可能性があります。私たちの研究室では、こうした角度から細胞内分解経路とアルツハイマー病などの神経変性疾患の関係について調べていきたいと考えています。
参考文献
神経突起の形成・伸展におけるRhoファミリー低分子量Gタンパク質の役割
神経細胞は、神経突起(軸索・樹状突起)、シナプス形成、細胞運動といったダイナミックな形態変化を伴いながら、複雑な神経回路を形成する。RasやRhoを代表とするG蛋白質は、外部刺激に応答するシグナル伝達経路と細胞骨格/輸送等の制御系を結びつけるスイッチ分子であり、神経回路が形成され機能する様々な過程で、このG蛋白質がキー分子としてはたらいていることを多くの研究が指し示している。しかしながら、神経突起が何本形成されるのか、細胞体のどこから出芽するのか、といった根本的な問題が未だ解決されていない。これは、ひとえに生きた細胞でこれらの分子群の活性を検出する系が無かったからである。
そこで、松田研究室中村グループでは、FRETの原理に基づくバイオセンサーを用いて、神経突起の形成・伸展時におけるRhoファミリー低分子量G蛋白質の時空間的な活性の制御機構の解析を行った。以下にこれまで得られた結果についてまとめる。
● 神経突起伸展時におけるRac1とCdc42の時空間的活性イメージング(文献1)
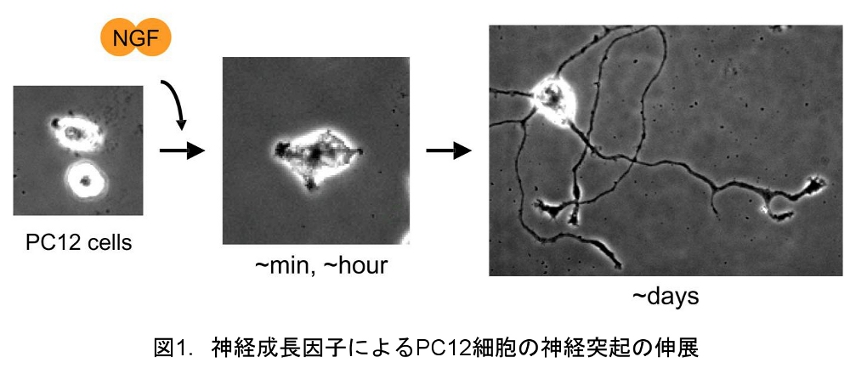
神経回路形成の過程のうち、まず、モデル細胞としてPC12細胞を用いて、神経突起の伸展制御の解析に取り組んだ。未分化のPC12細胞は、神経成長因子を加えることにより交感神経様に分化し、顕著な突起伸展を示す(図1)。
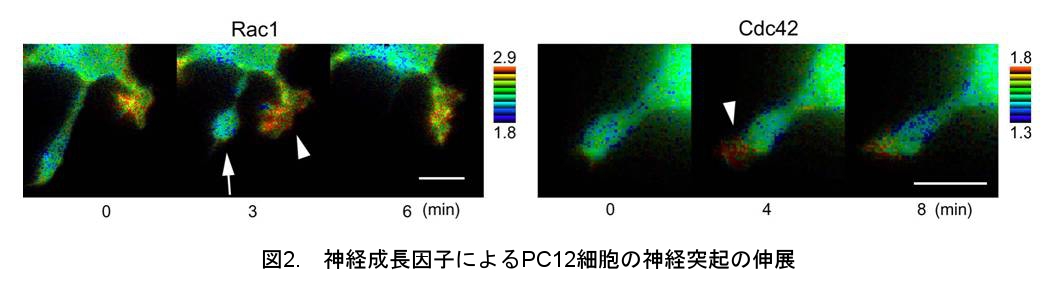
この突起伸展については、RhoファミリーG蛋白質に属するRac1とCdc42がアクチン細胞骨格の再編成を介して正に制御していると一般に考えられている。しかしながら、その突起伸展の過程で、実際にRac1とCdc42がどこでどのように活性化されているかについては直接的な情報が存在しなかった。そこで、松田研究室で開発されたFRET(fluorescence resonance energy transfer:蛍光共鳴エネルギー移動)の原理に基づくRac1とCdc42の活性モニター分子を用いて、神経突起伸展時におけるこれらの分子の活性制御を生きたPC12細胞で観察することを試みた。
その結果、神経成長因子の添加数分後に、細胞骨格の変化(ラメリポディア形成)に伴う全周性のRac1、Cdc42の活性化が観察された。しかしながら、この全周性の活性化は一過的で、刺激数十分後には突起の伸展部においてRac1とCdc42が局所的に活性化していることが分かった。これらの局所的な活性化は、成熟した神経突起や初代培養神経細胞の神経突起においても観察された。また、Rac1とCdc42の局所的な活性化が神経突起伸展に必要であることを示した(図2)。
● Rac1とCdc42の活性化因子としてVav2とVav3を同定(文献2)
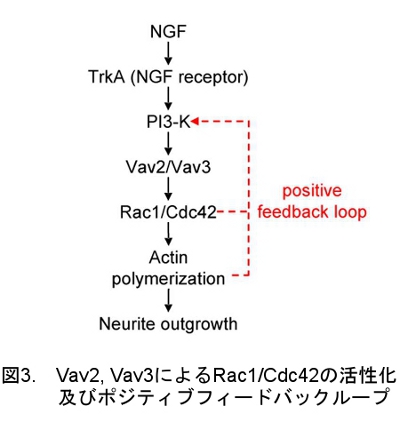
Rac1とCdc42の活性が時空間的に精密に制御されることが神経突起伸展に必要であることが上述の結果より明らかになった。そこで、次にRac1とCdc42の活性を制御する分子を同定することを試みた。阻害薬や優位性劣勢変異体を用いた解析から、Rac1とCdc42の活性化はPI3-Kが必要であることが分かっていたので、RNAi を用いてPI3-Kによって活性が制御されるRac1とCdc42の上流因子の検討を行った。その結果、Vav2とVav3が神経成長因子刺激によるRac1とCdc42の活性化において必要であることが分かった。また神経成長因子によって誘導される神経突起伸展においてVav2とVav3が必須であることが明らかになった。さらに、神経突起の伸展部においてPI3-K、Vav2/Vav3、Rac1/Cdc42、アクチン細胞骨格の分子間でポジティブフィードバック機構が存在することが分かった。これらのポジティブフィードバック機構は、細胞性粘菌や好中球などの走化性などでも同様に見出されており、神経細胞も同じシグナル伝達モジュールを用いていることを示唆している結果を得ることができた(図3)。
● フィードバックシステムを介した神経突起パターン形成機構(文献3)
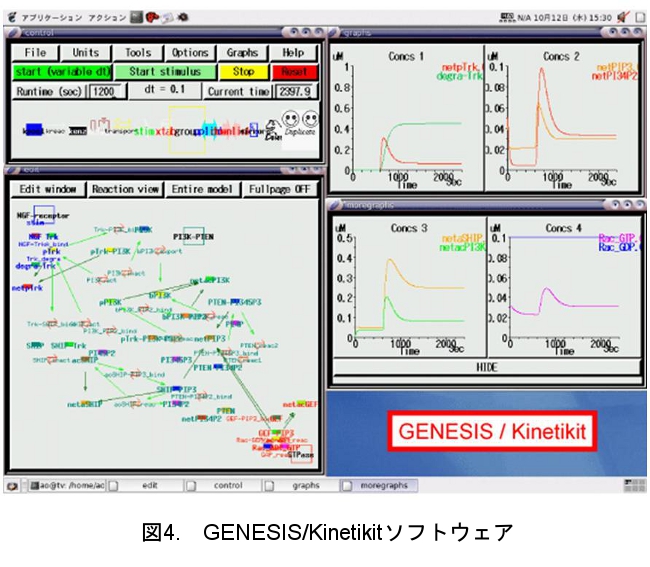
上記の結果から神経突起伸展過程におけるRac1とCdc42の活性制御機構が少しずつ明らかになってきた。しかしながら、統合的な理解には理論と実験が融合したシステムバイオロジー的な研究アプローチが必要である。そこで、神経成長因子シグナル伝達経路のモデル構築とコンピューターシミュレーションを行った。FRETイメージングと様々な阻害剤を組合せた実験結果を基に、GENESIS/Kinetikitプログラム上でシグナル伝達経路をモデル化し、シミュレーションによる解析を行った(図4)。
その結果、Rac1/Cdc42の活性はPIP3に大きく依存すること、さらに神経成長因刺激によってPI(3,4,5)P3の脱リン酸化酵素が活性化されることが強く示唆された。次に、RNAi法を用いてPIP3の脱リン酸化酵素をノックダウンしたところ、PTENとSHIP2のノックダウンによって、神経成長因刺激におけるRac1とCdc42の活性化、及びPIP3の蓄積が著しく亢進すること、また神経突起の異常形成が観察された。シミュレーションによってRac1依存的なポジティブフィードバック、ネガティブフィードバックが存在することが予測され、それらを実験的に証明することができた。
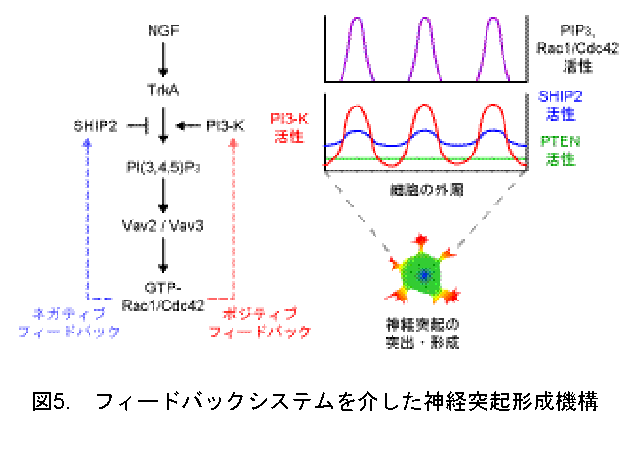
このことは、ポジティブフィードバック・ネガティブフィードバックによる自発的なパターン形成、すなわちチューリング波の形成条件の一つを満たしていた。そこで、チューリング波による周期的なパターン形成に重要な因子である活性化因子(Vav2)と不活性化因子(SHIP2、PTEN)の拡散速度の違いを蛍光イメージングで測定した。その結果、活性化因子が不活性化因子よりも拡散速度が遅いことが明らかになり、チューリング波によるパターン形成を支持することが分かった(図5)。
これらの結果は、細胞内シグナル伝達系に内包されたフィードバックシステムによる自律的な突起パターン形成モデル、という新たな神経突起形成モデルを提唱するだけでなく、細胞内シグナル伝達研究におけるシステムバイオロジーの有効性を十分示すものであった。(以上の内容は中村の前所属・京大松田研究室のホームページから引用・加筆しました。松田教授と関係者の方々に感謝いたします)
参考文献
エキソサイトーシス過程でのTC10タンパク質の活性化イメージング

小胞輸送とは、膜小胞が細胞膜および細胞内のオルガネラの間を行き来することにより、物質の輸送とコミュニケーションを行うプロセスである。小胞輸送が駆動する3つの経路-分泌(エキソサイトーシス)、リソソーム(液胞)経路、およびエンドサイトーシス経路-は、ダイナミックな膜の流れを実現し、生理的に重要なさまざまな役割を担っている。
松田研究室中村グループでは、エキソサイトーシスに関与するTC10タンパク質のFRETセンサー(Raichu-TC10)を作製して、その実験結果に基づき、TC10の小胞膜融合への関与について新しいモデルを提唱した。TC10はRhoファミリーのメンバーのひとつで、核周辺の内膜系、エキソサイトーシスされる小胞、細胞膜に存在する。TC10については、脂肪細胞をインシュリンで刺激した時のグルコーストランスポーターGLUT4の細胞膜への移行に関与することがよく知られているが、最近になってCFTR、AMPAレセプター、frizzledなどの輸送への関与も報告されている。
図1のRaichu-TC10でのFRETイメージングのデータが示すように、TC10の活性は小胞で最も高く、核周辺領域はやや低く、細胞膜が最も低い。つまり、TC10は核周辺の内膜系から小胞に移行するときにGTPが結合した活性型になり、細胞膜に移行する時にGTPが加水分解されて不活性型になる。
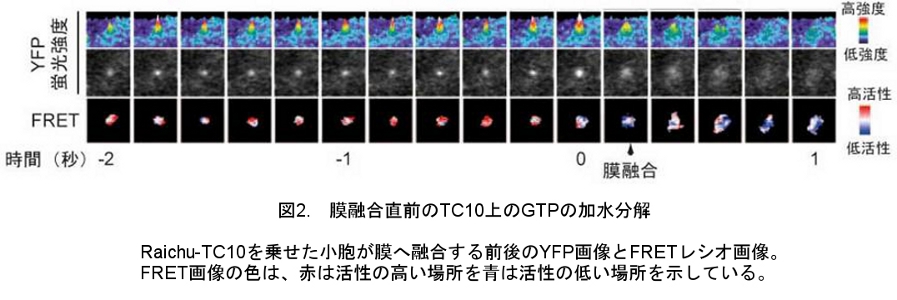
TC10上のGTPの加水分解の正確なタイミングを調べるために、全反射蛍光法を用いて膜融合の過程における小胞上のTC10のFRETイメージングを行った(図2)。その結果、膜融合の0.2秒前に小胞上のGTP-TC10が加水分解を受け、直後に細胞膜との融合が起きることが明らかになった。
加水分解を受けない恒常活性化型のTC10を細胞に発現させると、EGF刺激によるエキソサイトーシスや脱分極刺激によるニューロペプチドYの分泌が強く阻害される。このことから、各種の刺激により細胞膜近傍でGTPが加水分解されたTC10が、膜融合に関わるエフェクターをリリースし、それが引き金となって小胞が細胞膜に融合するというメカニズムが考えられる(図3)。また優勢劣性変異体やRNA干渉法を用いた解析により、EGF刺激によるTC10上のGTPの加水分解は、EGF刺激→Rac1活性化→活性酸素種の産生→p190RhoGAP-Aの活性化→TC10上のGTPの加水分解という経路で起きることが明らかになった。
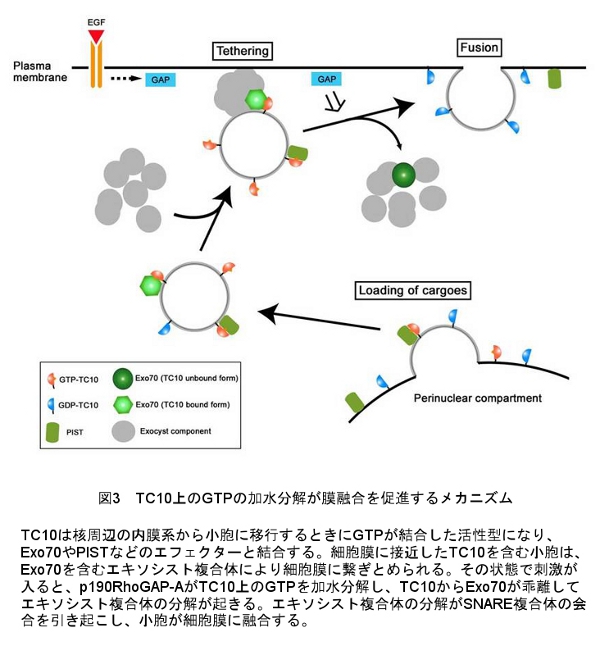
以上の成果は、TC10が細胞内の「いつ・どこで」活性型になり、また加水分解されたかを可視化できるFRETイメージン グにより初めて得られたものであり、細胞をすり潰してからデータを取得する生化学的な手法の限界を乗り越えたものということができる。(以上の内容は中村の前所属・京大松田研究室のホームページから引用・加筆しました。松田教授と関係者の方々に感謝いたします)
参考文献